肿瘤免疫疗法的潜力新星—溶瘤病毒
发布时间:2023-04-13来源:点击:1625
以下文章来源于:医药速览
溶瘤病毒是一种新型免疫疗法,可通过直接溶瘤作用和诱导抗肿瘤免疫反应特异性的杀死肿瘤细胞并豁免正常细胞,为不同类型的肿瘤患者带来临床获益。目前全球已有5款溶瘤病毒产品获批,更多的临床试验也在稳步推进中,考虑到溶瘤病毒与其他免疫疗法在抗肿瘤机制上的互补,未来与PD-1单抗、CAR-T等药物的联合治疗将可能是溶瘤病毒的应用场景。
PART01溶瘤病毒发展历程
溶瘤病毒(oncolytic viruses,OVs)作为癌症免疫治疗的一部分,最早可追溯到1904年的一名白血病患者,在患流行性感冒之后观察到异常白细胞数目减少;1911年以,一名颈部肿瘤患者颈部接种狂犬病毒活疫苗后观察到肿瘤体积的缩小。此后,越来越多的科研工作者投身于用病毒对抗肿瘤的研究;Martuza等于1991年报导的通过改造单纯疱疹病毒基因组治疗脑胶质瘤则为研究溶瘤病毒疗法的科研人员打开了一扇新的大门。2004年,拉脱维亚批准了第一个溶瘤病毒产品 Rigvir,用于治疗黑色素瘤,中国则分别于2004年和2005年批准了今又生和H101,用于治疗肝细胞癌和头颈癌。沉寂十年后溶瘤病毒迎来高光时刻,FDA批准了T-VEC,用于治疗黑色素瘤,2021年日本批准了Delytact用于治疗恶性胶质瘤。

PART02溶瘤病毒作用机制
靶向机制:无论是天然病毒还是经基因改造过的病毒,都是通过肿瘤细胞与正常细胞之间遗传特征和表观遗传的差异(如原癌基因激活、抑癌基因失活、肿瘤细胞表面某些受体高表达、缺氧酸性的肿瘤微环境以及信号通路异常等),来实现对肿瘤细胞的选择性感染和在肿瘤细胞内的选择性复制。比如脑胶质瘤细胞高表达CD155,而脊髓灰质炎病毒则能识别并结合CD155由此进入肿瘤细胞;肿瘤细胞中有缺陷的IFN表达或p53突变也可作为靶向途径,正常细胞被溶瘤病毒感染后可激发IFN表达/p53介导的细胞凋亡从而清除病毒,肿瘤细胞则因IFN缺陷及p53突变失去抗病毒能力;而针对在多种肿瘤细胞中高表达的尿激酶受体,则可对溶瘤病毒进行基因改造,在病毒表面引入能够结合尿激酶受体的抗体/受体,从而特异性识别肿瘤细胞;此外,也可以在病毒基因组里插入肿瘤特异性的启动子,如人端粒酶逆转录酶 (hTERT)启动子、癌胚抗原 (CEA) 启动子、甲胎蛋白 (AFP)启动子等来实现病毒仅在肿瘤细胞内复制。
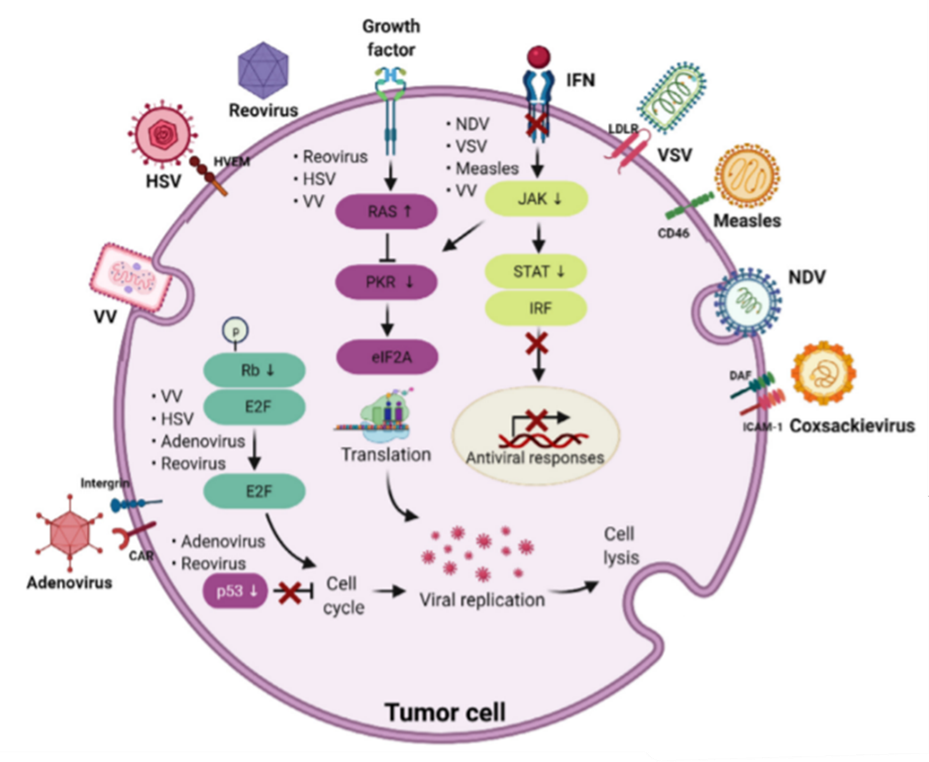
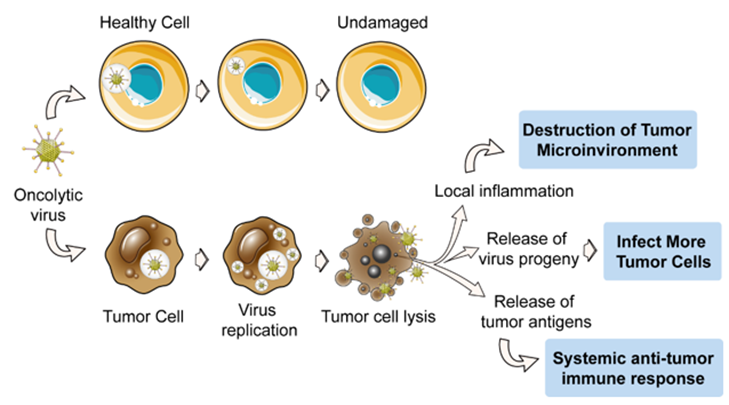
杀伤机制:OVs可通过多种途径发挥抗肿瘤作用,包括但不限于:直接溶瘤作用、诱导固有免疫应答杀伤肿瘤、诱导适应性免疫应答杀伤肿瘤、改变肿瘤微环境、破环肿瘤血供等。OVs侵入肿瘤细胞后,劫持肿瘤细胞的蛋白合成机器,开始大量复制,最终将肿瘤细胞裂解,并释放出新的OVs感染更多肿瘤细胞。与此同时,被感染的肿瘤细胞也会释放此外,OVs也可侵入肿瘤的血管内皮细胞,造成内皮细胞凋亡,影响肿瘤血供。此外,OVs还能通过诱导内质网应激来激活免疫原性细胞死亡(immunogenic cell death,ICD),引起损伤相关分子模式 (DAMPs)的释放,促进白介素、干扰素和趋化因子的释放,招募固有免疫细胞,将冷肿瘤变为热肿瘤;而肿瘤细胞裂解释放出的抗原,则能进一步的激活系统性的抗肿瘤免疫应答,产生CD8+T细胞和相应B细胞,实现对原位和转移肿瘤的杀伤。
PART03
溶瘤病毒种类
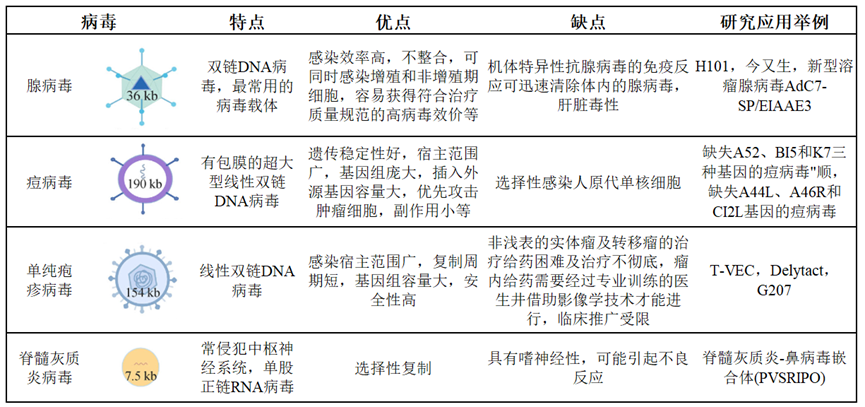
已有许多不同类型病毒被用于溶瘤病毒的开发,如腺病毒(AdV)、单纯疱疹病毒 (HSV)、牛痘病毒(VV)、呼肠孤病毒 (RV)、新城疫病毒 (NDV)、麻疹病毒 (MeV)、脊髓灰质炎病毒(PV)和柯萨奇病毒(CV)等。目前已经获得监管批准的溶瘤病毒主要来自HSV 和AdV 家族,其中FDA批准的T-VEC和PMDA批准的Delytact均为1型单纯疱疹病毒,NMPA批准的今又生和H101则分别为重组p53腺病毒和重组5型腺病毒。
PART04溶瘤病毒改造策略
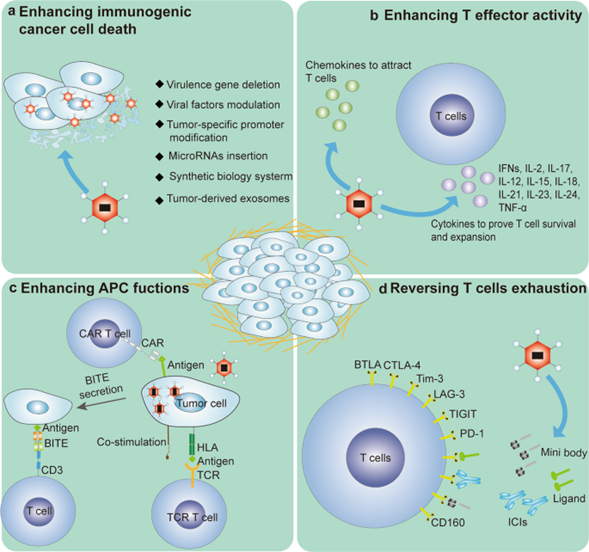
- 删除病毒基因组中非必须基因(如HSV的ICP34.5和ICP47、AdV的E1B-55)来减弱病毒的致病性,增强病毒对肿瘤的特异性裂解。
- 往病毒基因组添加共刺激分子基因(如OX40、CD40、ICAM-、B7-1、4-1BB)来提高抗原呈递和T细胞活化水平,增强抗肿瘤免疫应答。
- 往病毒基因组添加趋化因子基因(如CCL5、CXCL11),从而在肿瘤细胞中表达趋化因子,增强免疫细胞迁移和浸润,将“冷”肿瘤转变为“热”肿瘤。
- 往病毒基因组添加GM-CSF、IL-2、IL-7、IL-12、IL-15、IFN-α、IFN-β等细胞因子基因来增强抗肿瘤免疫反应。
- 往病毒基因组添加免疫检查点抑制剂(如CTLA4、PD-1、TIGIT、TIM-3、BTLA和 CD160)的基因序列,并在感染的肿瘤细胞中表达出来,从而恢复被抑制的T 细胞功能,减少CD8+ T细胞耗竭。
PART05溶瘤病毒与免疫疗法联合
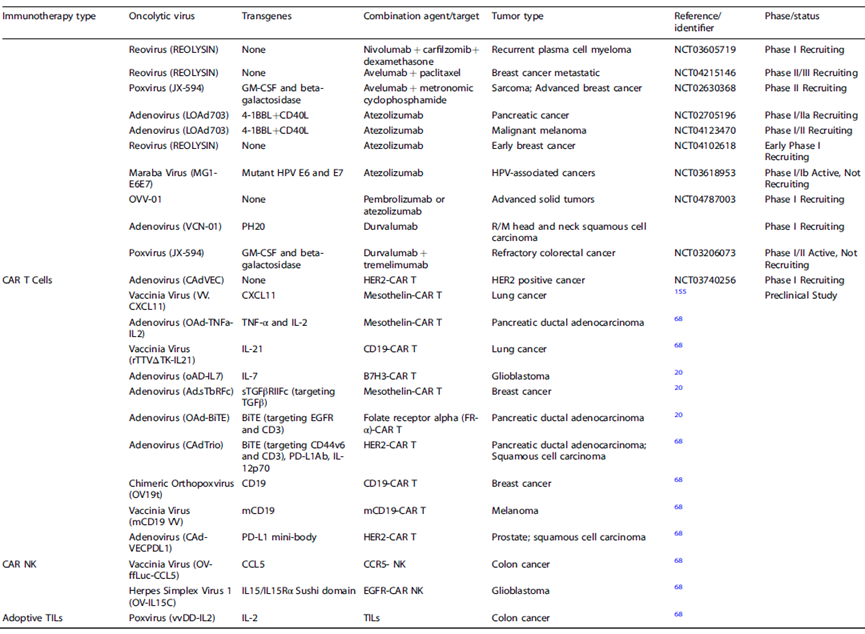
肿瘤免疫治疗是近10年来快速发展起的新一代肿瘤治疗方法,具有巨大的临床应用价值。免疫检查点抑制剂疗效好,但因实体瘤浸润的T细胞较少导致响应率不高,CAR-T等细胞治疗药物则因对实体瘤的渗透性不佳及耗竭导致目前市场主要局限于血液瘤。而OVs正好可以在这两点上和免疫检查点抑制剂及细胞治疗药物形成互补,OVs可以增加T细胞向肿瘤的迁移、增强T细胞存活和扩增、增强APC功能和逆转T细胞耗竭,“点燃”实体瘤,从而提高免疫检查点抑制剂和细胞治疗药物的疗效,因此OVs与免疫疗法的联合用药将是十分有临床前景的治疗方式。
目前全球已有超过45项临床试验在探索OVs与PD-1单抗、PD-L1单抗及CAR-T、CAR-NK的联合疗法,并展现不错疗效,但均处于较早期阶段,尚未有联合疗法正式获批。在一项T-VEC联合K药治疗晚期不可切除黑色素瘤的Ib期临床试验中,实现了62%的ORR,33%的CR,疗效明显优于单独使用K药或T-VEC,更大规模的II期试验得到了同样的结果。OVs与CAR-T的联合疗法则在临床前脑胶质瘤和黑色素瘤模型中展现了优异疗效,相比单独使用OVs或CAR-T可延长总生存期一倍以上。更多的联合疗法临床试验也在稳步推进中,相信随着研究的深入,联合疗法将有望正式获批,造福更多肿瘤患者。

来源: 医药速览



