FDA取消动物实验,类器官替代是否有机会独当一面?
发布时间:2023-04-13来源:点击:1401
以下文章来源于:bioSeedin柏思荟
去年圣诞节前夕,美国众议院批准了FDA现代法案2.0,该法案将允许新药不需要在动物上进行实验也能获得美国FDA的批准;也就是说,在研疗法进入临床开发阶段时,可以使用非动物实验数据评估疗法的效力和安全性。
非动物的检测手段,包括细胞模型、器官芯片和微生理系统、生物打印或计算模型等,将与动物模型视为同等重要的研究手段。这些研究工具经历了10到15年的开发。
新法案的批准标志着药物监管中动物使用的重大转变;也意味着正式将新工具纳入药物非临床实验环节。
FDA取消动物实验的原因主要有:
- 成本高。每只灵长类动物的购买成本在4,000美元到5,000美元之间(不包括住房和喂养成本),而替代动物可以节省10%至26%的药物开发研究成本;
- 研发周期长。使用来自患者的细胞可以将药物开发过程缩短一两年;
- 动物模型并不能完全模拟人类生物系统的复杂性。大约90%在动物身上被证明安全有效的药物,并没有在人类身上起作用;
- 在罕见疾病中,开发动物模型可能很昂贵或难以开发,而且患者数量少可能难以证明此类研究的合理性;
- 道德和伦理原因,特别是灵长类动物。
而新工具的替代使用离我们也并不遥远。实际上,2022年8月,美国FDA首次完全基于在人类器官芯片研究中获得的临床前疗效数据,与已有的安全性数据相结合,批准了赛诺菲补体C1s蛋白靶向抗体药物Sutimlimab治疗新适应症(两种罕见自身免疫脱髓鞘疾病)的临床试验IND申请。
这一批准没有使用传统动物实验提供的疗效数据,代表着组织芯片使用的重大里程碑。
不过,Sutimlimab当时已经是一款已上市的药物,在2022年2月获FDA批准上市用于治疗冷凝集素病,商品名:Enjaymo。
当然,动物实验不会在几年之间消失,非动物技术仍处于起步阶段,离大规模投入临床前研究还存在着差距;但监管机构将激励这些研究手段的使用和发展,新法案带来了文化转变,同时也平衡了当下动物保护主义组织、大药厂、政府之间的需求。
类器官
类器官指利用成体干细胞或多能干细胞进行体外3D培养而形成的具有一定空间结构的组织类似物。类器官能在结构和功能上模拟真实器官,并能够长期稳定传代培养。
不过,类器官并不仅仅是体外细胞模型的“仿真版”,其开发和发展本身就旨在解决动物作为临床前研究的一些限制,包括成本、周期、模拟效果等。减少动物实验后,未来类器官的角色有望“反宾为主”。
当前许多新药研发,包括大分子、小分子的药物发现阶段已经用上了类器官作为药物筛选、临床前药物评价等。
类器官用于疾病建模(来源:参考资料1)
类器官用于高通量药物筛选(来源:参考资料2)

类器官用于临床前PD/PK(来源:参考资料3)
类器官行业(此处包括器官芯片、生物打印)已经是辉瑞、艾伯维、强生、罗氏、默沙东、诺华、BMS、赛诺菲、GSK、阿斯利康、武田制药等MNC都在争相布局的领域。
国内药明康德、恒瑞医药、百济神州等头部药企都已将类器官技术应用到新药研发中;同时,丹望医疗、大橡科技、创芯国际、科途医学等诸多类器官企业在近几年不断涌现,融资事件频发。
2021年11月,CDE首次将类器官列入基因治疗及细胞治疗的验证指南基因治疗产品非临床药理学研究。
与传统的二维培养模型相比,类器官具有更接近生理细胞的组成和行为、更稳定的基因组,以及更适合于生物转染和高通量筛选等优势。
与动物评价体系相比,类器官可降低实验复杂性,适合实时成像技术,成本低;且解决种属差异问题,能应用于研究人类发育和疾病的各个方面。
从药物筛选角度来说,类器官在成功率、通量、临床相关性等方面均具有优势。
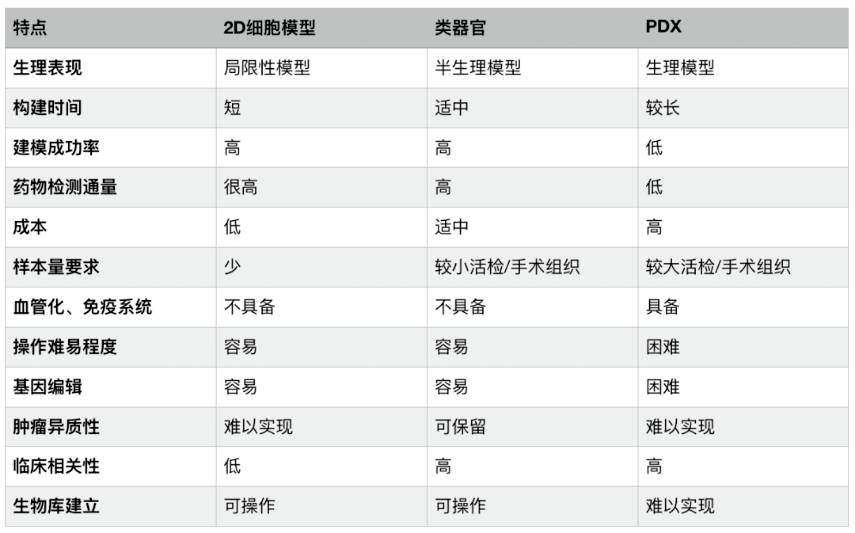
药筛模型对比(来源:澳银资本)
类器官为新模型和新技术的发展提供了更多的机会,不过也有局限性需要克服。目前类器官体系存在着可重复性低、不完善的细胞类型、普遍缺乏成熟度等问题,都会限制其在研究细胞类型特异性相关的正常或疾病过程中的总体效应。
器官芯片
相较于类器官,行业内对于器官芯片的认知较少。器官芯片是具有结构性的微型三维人体细胞体外培养,可以模拟三维多细胞层状结构,组织接口, 并具有微流控液体控制的优势,能构建物理化学微环境,提供精准的细胞微环境控制。
两者技术优势不同。类器官良好实现了人体器官的功能与形态,而器官芯片则是实现了人体器官的真实三微结构和微环境构建。
两者在各自的技术优劣间呈现了互补关系,也有越来越多的研究将两者结合,将体外模型往更仿真、更稳定可靠的路径去优化。
器官芯片的应用方向与类器官大同小异,从早期生物标志物发现、靶点确证、先导化合物优化、PK/PD研究到毒理学研究,涉足临床前研究的不同阶段。
举个例子,取代动物疗效数据、并帮助赛诺菲补体C1s抗体Sutimlimab(TNT-005)成功获批IND的器官芯片"Human-On-A-Chip",在临床前研究中建立了两种罕见的自身免疫性脱髓鞘性神经病模型。这些疾病目前缺乏有效模拟疾病症状的动物模型,因此无法利用动物模型来评估潜在疗法的效用。
该系统由人类iPSC分化形成的运动神经元和Schwann细胞组成,运动神经元(见下图B)是将信息从大脑传递到肌肉的细胞,Schwann细胞(见下图A)则有助于信号更快地移动。芯片中核心组件是微电极,在患者血清处理的电极上显示定向的轴突生长。
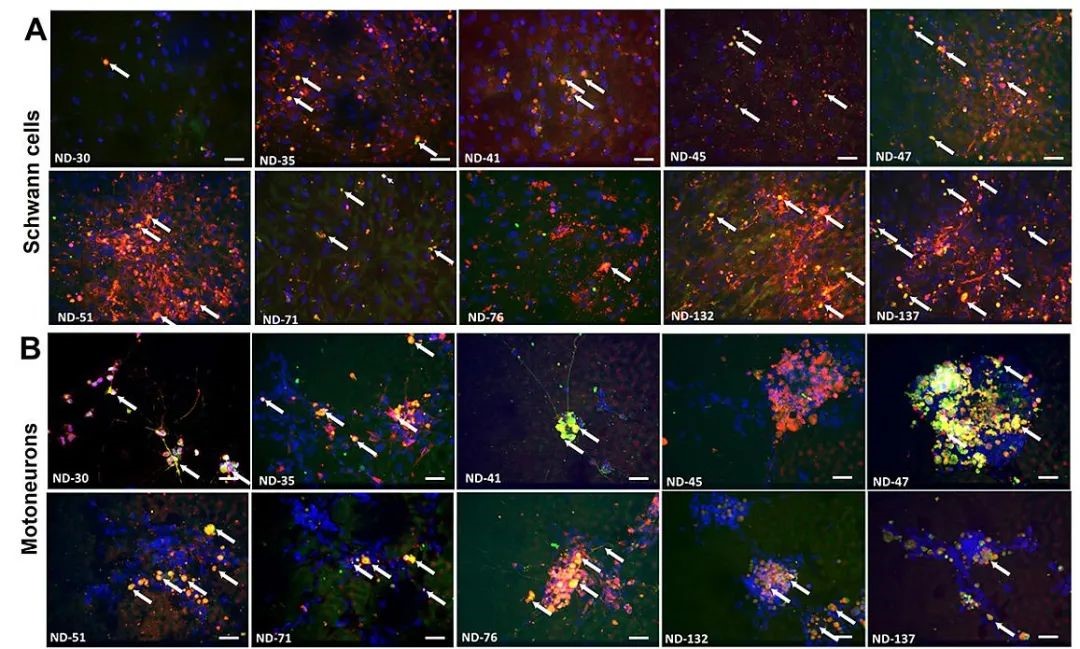
来源:参考资料4
在两种脱髓鞘疾病中,患者的血清包含着攻击髓鞘的自身抗体,导致髓鞘的损伤。研究人员利用器官芯片模型重现了这些在患者中观察到的临床特征,包括自身抗体对髓鞘的攻击,以及神经电信号的传导速度下降。而使用赛诺菲补体靶向抗体TNT-005,在模型中显示出神经功能的恢复。
该研究的疗效数据为赛诺菲提交IND申请提供了支持,并证明了该模型的转化潜力。
小结
FDA新法案的通过,仿佛是忽然之间改变了全球药物研发的“游戏规则”。不过,实则必然,类器官等新工具如今已经成为了吸引人、且具有显著优势的研究手段。
技术因素和政策因素和是推动新行业蓬勃发展的动力。虽然今天的类器官还不算成熟,但其技术发展正处于一个快速的推陈出新的阶段,不断给新药研发带来更成熟、更准确的筛选和验证方案。
未来,多器官的串联,让类器官由器官水平提升到系统水平,并完善体外和体内的关联体系是主要发展方向。如果这些都能实现,或许有朝一日不需要动物实验,让新工具独当一面。
FDA首席科学家Namandjé Bumpus表示,当替代方法准备就绪时,FDA支持跳过动物实验,但需要提供必要的数据证明产品的安全性和有效性,FDA也将继续鼓励动物实验替代方法数据的递交。
来源:bioSeedin柏思荟



