2023年中国CAR-T细胞治疗行业报告
发布时间:2023-06-07来源:点击:1787
CAR-T细胞治疗,又称为嵌合抗原受体T细胞免疫疗法(Chimeric Antigen Receptor T-Cell Immunotherapy),是指经过基因工程改造过的,可以表达特定T细胞受体,用于免疫治疗的一类T细胞。CAR-T中的嵌合抗体给予了改造后的T细胞识别特定蛋白的能力,嵌合一词的解释是因为其抗体既具有抗原识别功能也具有T细胞激活功能。CAR将针对肿瘤细胞相关抗原的抗体的scFv、T淋巴细胞受体的CD3或FceR1y等胞内信号激活基序融合成嵌合抗原受体,使T细胞识别肿瘤细胞表面的特定抗原,进而供给肿瘤细胞。
自体CAR-T细胞的制备首先从患者外周血中取出T细胞,然后进行体外扩增、纯化,检测CAR-T细胞的质量,最后灌输至患者体内。同种异体CAR-T细胞是使用同种异体来源或是从iPSC来源的T细胞制备而成的CAR-T细胞,又被称为通用型CAR-T细胞。
自体CAR-T细胞疗法
自体CAR-T细胞的制备首先须从患者外周血中取出T细胞,进行体外扩增、纯化,检测CAR-T细胞的质量并灌输至患者体内。此外,在制备CAR-T细胞的同时,患者须接受预处理化疗(即清淋),通常使用环磷酰胺或氟达拉滨等化疗药物减少机体对改造后的CAR-T细胞的排斥反应,以提高CAR-T细胞注入后的疗效。
同种异体CAR-T细胞疗法
无需从患者自身体内分离T细胞,而是直接使用健康人T细胞,通过基因编辑技术改造后进行大规模培养,最终回输到患者体内。因此同种异体CAR-T可提前制备好后储存,当有患者需要时可及时回输进患者体内,显著缩短了治疗周期。由于一个健康人的血液可制备大量同种异体CAR-T产品,治疗成本也显著降低。
中国CAR-T细胞治疗起步晚,但发展空间大。国内产品数量、产品销售额均落后于发达国家,仍有较大发展空间。CAR-T细胞治疗行业产品开发、商业化流程各阶段均存在较高的准入壁垒。CAR-T细胞治疗产品价格昂贵,国内CAR-T产品定价为120万人民币/针。
起步晚,但发展空间大
国内产品数量、产品销售额均落后于发达国家,仍有较大发展空间
国内首款产品于2021年上市,落后发达国家约4年。目前国内已上市品种较少,仅有两款CD19的CAR-T用于DLBCL治疗,且仍处于商业化初期阶段;另有传奇生物的Carvykti在美国上市,但尚未在国内注册。国内市场仍有较大发展空间
行业壁垒较高
CAR-T细胞治疗行业产品开发、商业化流程各阶段均存在较高的准入壁垒
CAR-T细胞治疗产品开发及商业化流程大致可分为靶点开发、产品设计、临床前研究、IND申报、临床研究、上市审批、产品生产及商业化、以及上市后研究几个部分。靶点开发阶段壁垒相对较低,靶点本身难以保护,后发公司有快速跟进机会。产品设计阶段和临床前研究阶段技术壁垒较高,结构和工艺的优化可能显著影响产品性能,对公司研发能力要求较高。IND和上市审批均需公司与监管机构进行沟通。细胞治疗产品创新程度高,这对公司及监管机构的沟通与合作提出了更高的要求。由于细胞治疗产品个性化程度高、不良反应复杂、且医生普遍临床处置经验不足,此类产品的临床试验难度高于常规药物开发,临床设计和管理能力可以显著影响临床试验的速度和成功率。细胞治疗产品的生产高度个性化,且储存运输条件严苛,对生产要求较高。监管部门普遍要求对细胞治疗产品开展上市后临床研究,对公司人力财力、以及临床管理能力要求较高。
价格昂贵
CAR-T细胞治疗产品价格昂贵,围治疗期同样费用不菲
CAR-T细胞疗法价格昂贵,美国定价40-50万美元;国内定价120万人民币;除药物本身费用,还需考虑围治疗期费用,包括检查、住院、控制副作用、ICU等。
由于细胞治疗的独特性,中国关于CAR-T细胞治疗的政策已经多次修改。自2009年起,CAR-T细胞疗法作为一种医疗技术被规范。2015年,卫生部规定细胞治疗只能以临床试验的形式进行。计划开发为药物的项目,必须向国家食品药品监督管理局提交相应的IND申请。2021年6月23日,首个获药监局批准上市的CAR-T产品阿基仑赛注射液。2021年9月3日,瑞基奥仑赛注射液获国家药监局批准上市。2022年2月28日,西达基奥仑赛获得FDA批准上市,5月26日获得欧盟批准上市。中国的CAR?T治疗行业虽然起步晚于美国,但发展迅速,所使用的技术处于行业前沿,研发的产品也具有一定程度的国际竞争力。
开始时间:2009 结束时间:2016 阶段:萌芽期
行业大事件:2009年7月,斯丹赛生物技术有限公司成立,主要从事干细胞与再生医学、分子生物学的新技术研发,并于2015年成功首例CAR-T临床试验。2015年2月,西比曼与中国人民解放军总医院生命科学院分子免疫学研究室研发合作4项CAR-T产品,并进行了难治性恶性血液肿瘤和恶性实体瘤的临床研究。
2015年11月,博生吉注册了两项CAR-T研究,针对实体瘤为靶点,适应症包括肝细胞癌、非小细胞肺癌、胰腺癌和三阴性乳腺癌等
行业影响:由于监管体制相对宽松,部分医疗机构科室在没有经过卫计委批准的情况下,纷纷开展免疫细胞治疗项目,各种形式的临床试验和临床应用项目数量迅速增加;CAR-T细胞治疗技术尚处于研发初期,中国CAR-T细胞治疗行业开始萌芽
开始时间:2016 结束时间:2021 阶段:启动期
行业大事件:2017年,NMPA将细胞治疗纳入治疗性生物制品进行申报管理,同年出台《细胞治疗产品研究与评价技术指导原则(试行)》;2018年6月5日,中国食品药品检定研究院发布《CAR-T细胞治疗产品质量控制监测研究及非临床研究考虑要点》;2018年9月7日,中国医药生物技术协会发布《嵌合抗原受体修饰T细胞(CAR-T细胞)制剂制备质量管理规范》;2020年7月7日,CDE发布《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》
行业影响:中国出台多项政策指导CAR-T细胞免疫治疗技术的健康发展。随着行业监管日趋完善,进入到规范化,国内CAR-T细胞免疫治疗行业的产业化进程将逐步启动
开始时间:2021 结束时间:2022 阶段:高速发展期
行业大事件:阿基仑赛注射液于2021年6月23日首个获药监局批准上市的CAR-T产品。瑞基奥仑赛注射液于2021年9月3日获国家药监局批准上市。截至2022年5月,国内已有20多家企业参与到CAR-T产品的研发当中
行业影响:已在中国上市CAR-T产品逐步放量,并且CAR-T在中国上市申请进展加快,有望助力行业规模快速扩容
CAR-T细胞治疗产业链可划分为上、中、下游产业3个环节。上游环节的企业主要包括生物原料、关键设备、试剂及耗材,这些关键设备及试剂供应商多来自跨国公司,如德国美天旎、默克、赛默飞世尔等。中游环节的企业主要包括CAR-T细胞治疗研发机构、负责CAR-T细胞治疗技术的研发、注射剂的生产及销售,其中质粒和病毒制备为关键,其制备过程及质量控制需要大量资金投入。下游环节的企业主要包括第三方外包服务商(CSO为主)、综合三甲医院、肿瘤专科医院、癌症治疗中心。CSO企业的价值在于使上游高度分散的产品能够准确、高效地到达高度分散的各类终端,在这个过程中,CSO企业承担着仓储物流、信息匹配、产品推广、售后服务等一系列职责。CSO企业通过分销药物,获得销售分成。

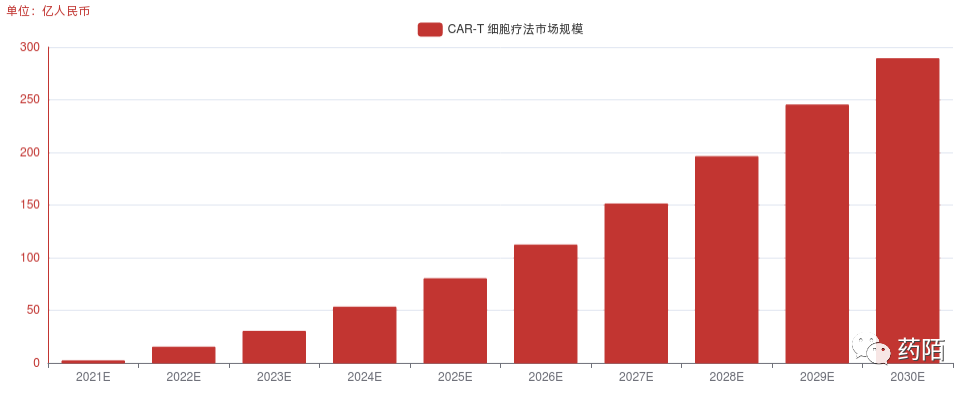
截至2022年8月,中国已批准了两款CAR-T细胞疗法上市。2021年中国CAR-T疗法的市场规模约2亿人民币,2030年将增长至289亿人民币,2022-2030年的复合增长率为45.0%
不断扩大的癌症患者人数。受人口老龄化加剧,生活方式改变及环境问题等因素影响,中国新发癌症患者和癌症死亡人数占比在全球最高。2020年全球新发癌症病例
1929万例,其中中国新发癌症457万例,占全球23.7%;2020年全球癌症死亡病例996万例,其中中国癌症死亡病例占全球30%。庞大的患者需求为国内CAR-T细胞疗法提供了一个巨大的市场潜力。这也是中国CAR-T市场规模增速明显高于全球的原因之一
创新性保险覆盖模式增加药物可及性。CAR-T细胞疗法大多费用高昂,国内上市的两款产品分别为120万元/针和129万元/针,国外上市的CAR-T产品大约40万美元/针,对患者造成了沉重的经济负担。为提高药物的可及性,欧美国家逐步形成“商业保险+医疗保险的”多元支付模式,对中国具有一定的借鉴意义。未来可能会增加医疗保健开支以及对昂贵、创新疗法的接受度变大。当前,国内已经有多款商业保险可报销CAR-T细胞治疗费用,如平安健康险、复星联合超越保等
监管审批政策推动中国CAR-T行业持续发展。监管审批政策推动中国细胞治疗行业持续健康发展。自2009年起,中国医疗系统历经重大变革,颁布了多项鼓励药物创新、简化申请审批流程以及扩大医疗报销范围的政策。目前细胞治疗大多针对复发难治性肿瘤或罕见病,因此相较于传统药物,其更容易被纳入突破性治疗药物评审名单中。在这些有利政策和指引的指导下,CAR-T细胞治疗药物可以简化研发和上市注册程序,进一步推动国内CAR-T细胞疗法市场快速增长及持续健康发展。
中国CAR-T细胞治疗市场规模,2021E-2030E
政策名称:《CAR-T细胞治疗产品质量控制检测研究及非临床研究考虑要求》 颁布主体:食品药品检定研究院 生效日期:2018 影响:7
政策内容:细胞治疗临床试验可分为早期临床试验阶段和确证性临床试验阶段,有助于极大减少临床试验所需时间;可以有条件地免除非临床试验、接受非注册临床试验数据
政策解读:明确了CAR-T细胞治疗的监管原则(包括使用范围和质量健康等),为企业研发和行业发展铺平了道路
政策名称:《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》 颁布主体:CDE 生效日期:2020 影响:8
政策内容:免疫细胞治疗产品在开展临床试验时的一般考虑及个体化治疗产品的特殊考虑,对免疫细胞治疗产品开展探索性临床试验和确证性临床试验的研究目标、研究方法和评价方式等进行了阐述
政策解读:为开展免疫细胞药物临床试验的研究者提供更具针对性的建议和指南
政策名称:《关于推动我国细胞产业高质量发展的提案》 颁布主体:国家卫健委 生效日期:2020 影响:7
政策内容:明确将根据细胞临床研究项目实施进展情况,基于临床研究结果,前瞻性研究提出临床应用转化的有关政策建议。同时积极落实临床研究项目备案绿色通道制度
政策解读:强化对细胞临床研究机构开展细胞临床研究项目的辅导和指导,共同推进细胞产业发展
政策名称:《免疫细胞治疗产品药学研究与评价技术指导原则(征求意见稿)》 颁布主体:CDE 生效日期:2020 影响:7
政策内容:发布《免疫细胞治疗产品药学研究与评价技术指导原则(征求意见稿)》。适用于按照药品管理相关法规进行研发和注册申报的免疫细胞治疗产品,包括但不限于细胞因子诱导的杀伤细胞(CIK)、肿瘤浸润性淋巴细胞(TIL)、嵌合抗原受体T细胞(CAR-T)、T细胞受体修饰T细胞(TCR-T)、自然杀伤细胞
政策解读:明确了提出将细胞治疗的风险控制放在首要位臵,同时对该类产品的药学研究、药理毒理学研究、临床研究均做出了规范性指导
政策名称:《免疫细胞治疗产品临床试验技术指导原则(试行)》 颁布主体:CDE 生效日期:2021 影响:9
政策内容:该指导原则介绍了免疫细胞治疗产品在开展临床试验时的一般考虑及个体化治疗产品的特殊考虑,对免疫细胞治疗产品开展探索性临床试验和确证性临床试验的研究目标、研究方法和评价方式等进行了阐述,并提出免疫细胞治疗产品长期随访的相关要求
政策解读:该指导原则为免疫细胞治疗产品研发提供可参考的技术标准。从公开征求意见到正式颁布历时7个月,充分体现了国家药监局对免疫细胞治疗产品的研究、转化和产业发展的高度重视
差异性的竞争优势(产品广度——企业不同适应症的产品数量,创新力度——企业产品的不同靶点数量)能使企业在当前火热的CAR-T赛道中脱颖而出。CAR-T常见靶点与适应症:大部分应用的CAR-T靶点都是肿瘤抗原靶点。目前靶点主要布局在CD19上,其次为BCMA(均为血液瘤相关靶点)。实体瘤CAR-T中,较热门的靶点有CLDN18.2、GPC3、MSLN、EGFR和HER2。靶点的差异化设计可以有效改进产品的疗效。不同靶点的产品,临床效果可能出现较大差异。企业多靶点研发产品,在一定程度反映了其创新研发能力。



